AeroGlu : son processus de naissance
AeroGlu : introduction et fonctionnalités
AeroGlu est reconnu comme le matériau solide le plus léger au monde, composé à 97 % d'air et à 3 % de structure solide, avec une densité seulement 1,5 fois supérieure à celle de l'air. Outre son extrême légèreté, AeroGlu possède également d'excellentes propriétés isolantes grâce à l'effet Knudsen. AeroGlu est principalement composé de silice et d'air, la silice ayant une conductivité thermique moyenne et l'air une faible.
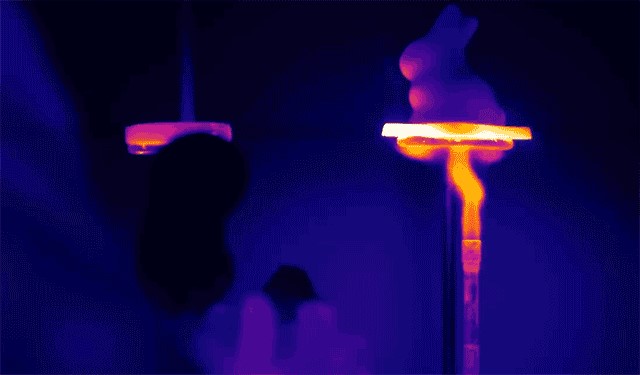

De plus, AeroGlu possède de nombreux pores à l’échelle nanométrique qui empêchent l’air de diffuser à travers le matériau, empêchant ainsi le transfert de chaleur par convection.

En raison de sa capacité à résister à des températures élevées, AeroGlu est souvent utilisé comme matériau isolant dans les rovers martiens et autres véhicules.
De plus, la résistance à l'eau de l'Aeroglu est obtenue par modification, où le groupe polaire –OH est converti en groupe non polaire –OR, ce qui donne un Aeroglu hydrophobe.
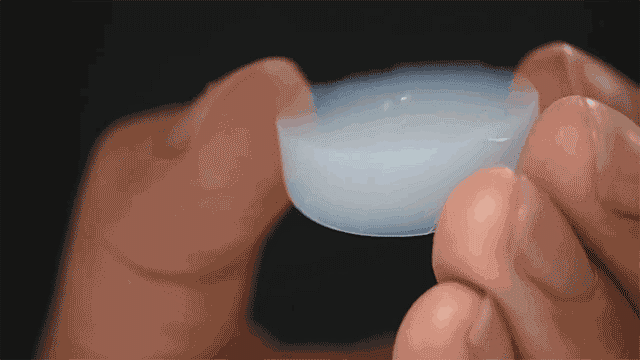

Bien qu'il ressemble à un produit de pointe issu d'une technologie futuriste, AeroGlu a en fait été développé pour la première fois dans les années 1930 par le chimiste Samuel Kistler.
La naissance du premier AeroGlu
Les substances gélifiées comme la gélatine sont courantes, et la gélatine que nous consommons est également une combinaison d'états solide et liquide. Samuel Kistler et son collègue Charles Learned ont parié sur la raison pour laquelle la gélatine forme un gel. Charles pensait que c'était dû à ses propriétés liquides, tandis que Samuel soutenait que la présence d'une structure solide au sein du gel était la clé.
Pour prouver ses affirmations, Samuel a réalisé des expériences visant à démontrer l'existence d'un réseau solide continu au sein d'un gel humide. L'objectif était d'éliminer le liquide du gel tout en conservant sa structure solide, prouvant ainsi son indépendance vis-à-vis de ses composants liquides. Cependant, si l'on laissait simplement le liquide s'évaporer du gel, la structure solide se contracterait sous l'effet des forces d'attraction intermoléculaires, provoquant l'effondrement du gel.

Pour résoudre ce problème, Samuel devait remplacer le liquide du gel. La seule option appropriée était un gaz, car le gel contenait déjà les états solide et liquide. Mais les gaz classiques ne pouvaient pas remplacer le liquide du gel. Samuel adopta une nouvelle approche : il pressurisa et chauffa le gel, transformant le liquide au-delà de son point critique en un fluide supercritique (un état dans lequel il n'y a pas de distinction entre liquide et gaz), éliminant ainsi les forces d'attraction entre les molécules.
Samuel a choisi le silicate de sodium comme matière première et a utilisé l'acide hydroxylique comme catalyseur pour favoriser l'hydrolyse. L'eau et l'éthanol ont servi de solvants pour l'échange, ce qui a donné naissance à un alcogel. Ce dernier a été placé dans un environnement à haute température et pression. Une fois l'éthanol à l'état de fluide supercritique, le gel a été libéré de la pression. Lorsque la pression a diminué, les molécules d'éthanol ont été libérées sous forme gazeuse. Une fois retiré de la source de chaleur et refroidi, l'éthanol contenu dans le gel s'est évaporé, laissant derrière lui une structure solide remplie de gaz : le premier aérogel.
L’étude a été publiée dans la revue Nature en 1931.
Méthode de fabrication AeroGlu améliorée

Bien que révolutionnaires, les recherches de Samuel ont stagné pendant plus de 30 ans en raison des conditions de préparation difficiles et chronophages. L'Université de Lyon, cherchant Aeroglu comme matériau poreux pour le stockage de l'oxygène et du carburant pour fusées, a revisité Aeroglu en 1970 et amélioré la méthode de Samuel.
Dans la nouvelle méthode, le silicate de sodium a été remplacé par du tétraméthoxysilane (TMOS) et l'éthanol par du formaldéhyde. Ce changement a permis d'obtenir un alcogel d'aérogel de silice de meilleure qualité et de réduire considérablement le temps de préparation. Cette amélioration a marqué une avancée significative dans la science des aérogels.
Après ces améliorations, en 1983, le groupe des matériaux microstructurés du Berkeley Lab a découvert que le TMOS, hautement toxique, pouvait être remplacé par le tétraéthoxysilane (TEOS), sûr, et que le CO2 liquide pouvait être utilisé avant le séchage supercritique sans endommager l'alcool dans le gel.
Il s'agit d'une avancée majeure en matière de sécurité, car le CO2 ne présente pas le danger explosif de l'alcool. À mesure que les recherches sur l'aérogel se sont approfondies, les physiciens ont compris que ce matériau nanométrique pourrait être utilisé pour capter les particules de rayonnement Tcherenkov qui peinent à traverser la structure complexe de l'aérogel.
En plus de collecter des particules fines, des aérogels de silice fabriqués au Jet Propulsion Laboratory de la NASA ont été envoyés dans l'espace dans le cadre d'une mission visant à collecter des grains de poussière provenant de comètes.

Compte tenu des caractéristiques de l'AeroGlu et des améliorations constantes des méthodes de fabrication, il est clair qu'il s'agit d'un matériau supérieur. Mais compte tenu de ses avantages, pourquoi n'est-il pas plus largement utilisé ?
Tout d’abord, la fabrication est un défi, et même si les méthodes de fabrication ont été améliorées à plusieurs reprises, les conditions supercritiques restent un obstacle majeur.
Deuxièmement, la production industrielle d'AeroGlu est complexe en raison de sa grande fragilité. Malgré sa forte capacité de charge, sa résistance à la traction est très faible et il est susceptible de se briser à la moindre force ; des additifs supplémentaires sont donc généralement nécessaires.

